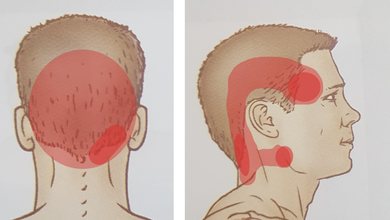
Përpjekja e Moderna për të revolucionarizuar mbrojtjen sezonale kundër gripit po përballet me një pengesë të madhe, pasi Food and Drug Administration (FDA) ka lëshuar një letër të rrallë “refuse to file” (refuzim për shqyrtim) për kandidatin e saj shumë të pritur të vaksinës mRNA.
Food and Drug Administration ka ndërmarrë hapin e pazakontë për të refuzuar shqyrtimin e aplikimit të Moderna-s për vaksinën e saj të parë sezonale kundër gripit me bazë mRNA. Sipas agjencisë, studimet klinike të kompanisë nuk kanë përdorur si krahasim vaksinat më efektive “standard of care” për pjesëmarrësit mbi 65 vjeç.
Ndërsa Moderna pretendon se FDA e kishte miratuar më herët projektimin e studimit, zyrtarë të Department of Health and Human Services (HHS) argumentojnë se kompania ka anashkaluar udhëzimet e vitit 2024 për testimin kundrejt dozave të larta të rekomanduara nga Centers for Disease Control and Prevention (CDC).
Ky veprim “refuse-to-file” është jashtëzakonisht i rrallë — ndodh në rreth 4% të aplikimeve — dhe në praktikë bllokon hedhjen në treg në SHBA të një teknologjie që synon të prodhohet më shpejt dhe me më shumë saktësi sesa vaksinat tradicionale të gripit.
Vendimi ka nxjerrë në pah përplasje të konsiderueshme brenda zyrës së vaksinave në FDA. Sipas raportimeve, Dr. David Kaslow, drejtues i divizionit të vaksinave, nuk ka qenë dakord me refuzimin dhe ka refuzuar të nënshkruajë letrën zyrtare, duke detyruar drejtorin e biologjikëve të agjencisë ta firmosë vetë — një hap i pazakontë.
Ky ngërç rregullator vjen në një klimë politike në ndryshim, pasi administrata aktuale ka tërhequr së fundmi fondet për disa projekte mRNA. Megjithëse FDA pohon se drejtuesit politikë nuk kanë ndërhyrë në këtë vendim specifik, kjo pengesë vonon planet e Moderna-s për një vaksinë të kombinuar kundër COVID-19 dhe gripit në SHBA. Si reagim, Moderna pret që miratimet e para për këtë teknologji t’i marrë nga rregullatorët evropianë brenda këtij viti.